| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Cenni di statistica di base. Calcoli di regressioni e correlazioni. novembre 2005 |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous slide, 5 | (large page > 200KB) next slide, 7 |
Leggendo attentamente tutta la slide forse scoprirete qualche cosa in piu' sugli elettrodi ionoselettivi anche tenendo conto che ci serviremo dei dati prodotti da uno di questi sensori per descrivere i calcoli necessari alla regressione. Diamo ora una descrizione, seppur sommaria, del loro funzionamento.
Si definisce Ion-Selective-Electrodes (ISE) un insieme di celle elettrolitiche raccolte in un unico contenitore che risponde logaritmicamente (per alcuni ordini di grandezza in concentrazione) al variare di uno ione detto analita. Un ISE dovrebbe seguire l'equazione di Nernst o quella di Nicolsky-Eisenman.
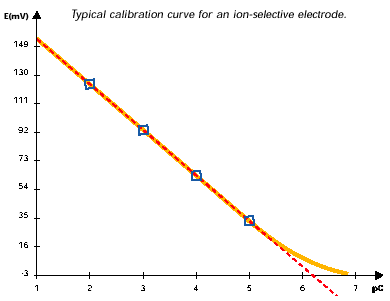
Come vediamo dal disegno a fianco al variare della concentrazione dell'analita si ha una variazione potenziale in mV della semicella. Variazione che confrontata con un elettrodo a potenziale costante (che nel caso degli elettrodi combinati e' interno) fornisce una FEM o piu' praticamente una ddp (differenza di potenziale).
Praticamente un elettrodo combinato, ISE+riferimento, si comporta come una pila la cui tensione e' proporzionale alla concentrazione dell'analita. Pero' si tratta di una pila di cui BISOGNA misurare il valore della FEM. Effettivamente l'elemento sensibile di un elettrodo e' una membrana (solida, gas permeabile, vetrosa, plastica) su cui si forma il potenziale di giunzione.
Un ISE e' percio' capace di produrre una risposta logaritmicamente proporzionale al variare della concentrazione a partire dal L.O.D. (nel disegno circa pC=6) fino alla saturazione del segnale per alte concentrazioni (nel disegno circa pC=1).

Ne esistono tanti di elettrodi e tanti di fabbricanti fra cui Metrohm, Phoenix, Mettler, Sartorius, Radiometer, Orion. Sui loro siti internet troverete di certo l'elettrodo che vi serve.
Per l'esempio prendiamo un caso reale, l'elettrodo ISE Metrohm Chlorine 6.0502.120 sensibile allo ione Cl - in soluzione acquosa. Per costruire la "retta di calibrazione" si devono prima preparare varie soluzioni a titolo noto di ione cloro.
Bisogna porre attenzione alle soluzioni a bassa concentrazione, vanno preparate con il minimo numero di passaggi possibile e nella costruzione della retta di calibrazione si inizia a studiare l'elettrodo in queste per poi passare a quelle piu' concentrate. Per produrre concentrazioni equispaziate nell'asse X, logaritmico, si possono preparare soluzioni con valori 1, 2, 5, 10, 20, 50, ... .
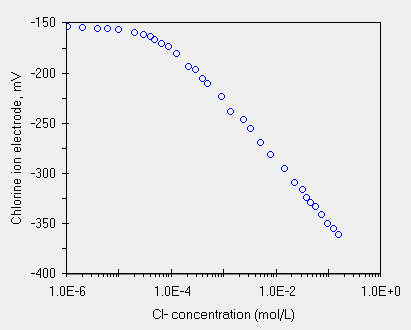
La retta di calibrazione qui presentata e' tipica di uno ione negativo, con sull'asse X le concentrazioni logaritmicamente crescenti. Per studiare attentamente sia la zona del L.O.D. sia la zona di linearita', con la regressione, si noti che la curva contiene un buon numero di punti. Analizzeremo questa curva con la regressione.
Bisogna porre attenzione anche a vari aspetti chimico-fisici come la temperatura, il pH, presenza di altri ioni interferenti, luce, vibrazioni.
Ecco nella tabella qui sotto i valori rilevati da un nostro studente in una delle prove dell'elettrodo.
| Conc. Mol/L | 1.05 x 10-6 | 2.09 x 10-6 | 4.07 x 10-6 | 6.31 x 10-6 | 1.02 x 10-5 | 2.04 x 10-5 | 3.09 x 10-5 | 4.07 x 10-5 | 5.01 x 10-5 | 6.76 x 10-5 | 8.91 x 10-5 | 1.29 x 10-4 | 2.24 x 10-4 | 3.02 x 10-4 | 4.07 x 10-4 | 5.01 x 10-4 |
| mV | -154.0 | -154.8 | -155.2 | -155.7 | -156.5 | -159.4 | -161.8 | -163.2 | -166.2 | -170.0 | -172.9 | -180.6 | -192.7 | -196.4 | -204.7 | -209.7 |
| Conc. Mol/L | 9.55 x 10-4 | 1.41 x 10-3 | 2.45 x 10-3 | 3.39 x 10-3 | 5.13 x 10-3 | 7.94 x 10-3 | 1.48 x 10-2 | 2.29 x 10-2 | 3.24 x 10-2 | 3.89 x 10-2 | 4.79 x 10-2 | 5.75 x 10-2 | 7.59 x 10-2 | 9.77 x 10-2 | 1.29 x 10-1 | 1.58 x 10-1 |
| mV | -222.3 | -236.9 | -244.2 | -253.0 | -267.6 | -278.6 | -292.6 | -306.2 | -313.2 | -320.8 | -325.2 | -329.8 | -336.9 | -346.1 | -351.4 | -356.7 |
Questo e' il punto piu' importante. La regressione che si usa normalmente in chimica e' quella dei "minimi quadrati" o in inglese Ordinary Least Squares. Per definizione questa regressione deve partire da valori "noti" per le X, praticamente senza errore.
Gia' il non poter azzerare l'errore sull'asse X portera' a gravi problemi, comunque nel tentativo di minimizzare l'errore sulla concentrazione consigliamo ancora di utilizzare il metodo della pesata diretta, come gia' visto nella slide precedente aiutandoci con il file error_on_solutions.123 nel solito formato Lotus 123.
Per prima cosa bisogna conoscere la precisione del metodo-strumento-tecnica con cui si svolgeranno le misure, e poi preparare soluzioni con almeno un valore di precisione 10 volte superiore (potendo anche 100 volte!!).
| previous slide | (large page > 200KB) next slide |