| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Cenni di statistica di base. Calcoli di regressioni e correlazioni. novembre 2005 |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous slide, 19 | next slide, 21 |
Senza usare la validazione, vista nella slide precedente, e' difficile valutare se la concentrazione misurata e' in qualche modo disturbata da un effetto matrice.
L'effetto matrice puo' sia far aumentare il valore misurato (qualche interferente che si somma al valore da misurare) sia far diminuire il valore (per qualche effetto di cattura o mascheramento da parte della matrice). Questo effetto e' detto Bias in inglese.
Come al solito diamo la definizione della IUPAC del metodo dell'aggiunta: Bias may also be estimated by comparison of the particular method with a value determined by the method of standard additions, in which known quantities of the analyte are added to the test material, and the correct analyte concentration inferred by extrapolation. The uncertainty associated with the bias is then normally dominated by the uncertainties associated with the extrapolation, combined (where appropriate) with any significant contributions from the preparation and addition of stock solution. NOTE: To be directly relevant, the additions should be made to the original sample, rather than a prepared extract.
Prendiamo uno dei due esempi che abbiamo utilizzato per tutte le slide, potevamo scegliere la spettrofotometria UV/Vis, ma invece concentriamoci sull'elettrodo ISE che ha forse problemi anche maggiori nello studio di un analita in una matrice.
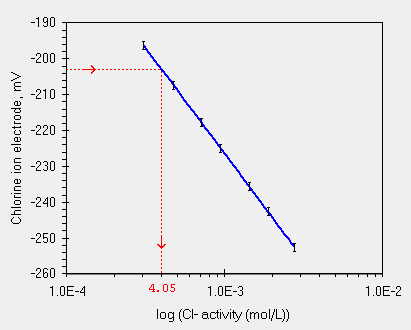
Abbiamo gia' visto che questo elettrodo e' sensibile alla concentrazione dello ione Cl -. Nella curva di calibrazione la misura della F.E.M. di circa -203.1 mV dell'elettrodo produrrebbero una concentrazione di 4.05 x 10-4 mol/L.
 |
| misura del segnale e calcolo della Conc. incognita |
Abbiamo gia' parlato in precedenza della selettivita'. Ora e' il momento di studiare come risponde il sensore-trasduttore-strumento al variare della concentrazione dell'analita direttamente nella matrice sotto indagine.
Nel caso qui sopra i -203.1 mV non sappiamo se sono la risposta dell'elettrodo al solo analita o anche (attraverso i coefficienti di selettivita') ad altri ioni presenti.
Se ci fosse il solo anione Cloro nella soluzione ci si potrebbe attendere il potenziale dovuto alla sola equazione di Nernst. Con la regressione possiamo "calcolare" i parametri E0 e RT/nF.
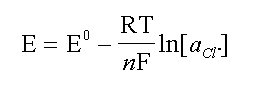
Ma se ci fossero altri ioni in soluzione ed il sistema di misura (l'elettrodo* in questo caso) fosse sensibile anche a questi l'equazione sarebbe molto piu' complessa, di B.P. Nicolsky - G. Eisenman, e non certo risolvibile con una regressione monovariata.
Per controllare il valore di 4.05 x 10-4 si potrebbe diminuire il numero di ioni Cl- in soluzione. Si potrebbe aggiungere una piccola quantita', nota, di ioni argento che formerebbe un precipitato di AgCl insolubile e leggere il nuovo valore in mV.
Questo non e' sempre possibile, e' molto piu' facile aggiungere lo ione e misurare la risposta. Questo metodo e' chiamato [SAM, standard know addition method] e si esplica mediante varie aggiunte, ben note, dell'analita**.
Anche per semplificare i calcoli con la SAM e' meglio aggiungere analita per raddoppiare la concentrazione e poi, con una seconda aggiunta, raddoppiare ancora la concentrazione. Facciamo due esempi.
Per il primo esempio scegliamo la via piu' facile. Consideriamo che nella soluzione non ci siano ioni che disturbano la risposta dell'elettrodo. Aggiungiamo ioni Cl- ad una concentrazione (nel volume totale finale) 4.00 x 10-4 e misuriamo il valore in mV. Poi aggiungiamo ione Cl- ancora questa volta con 8.00 x 10-4 moli/L.
| SAM | ione Cl- aggiunto | valore teorico | mV letti |
| iniziale | 4.05 x 10-4 | -203.1 | |
| I aggiunta | 4.00 x 10-4 | 8.05 x 10-4 | -220.3 |
| II aggiunta | 8.00 x 10-4 | 16.05 x 10-4 | -238.1 |
Nella tabella sono mostrati i risultati ottenuti. Ora riportiamo nel grafico che mostra la curva di calibrazione ottenuta in precedenza i due nuovi valori. Partendo dai valori in mV e calcolando la X otteniamo i valori in verde.
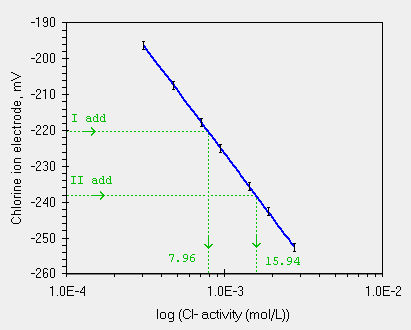 |
| le due Conc. calcolate, diverse ma negli errori sperimentali |
Ora bisognerebbe scrivere una formula che permetta di calcolare da ognuna di queste concentrazioni il valore iniziale. Non e' difficile ma si trova sui libri di chimica analitica o sulle raccomandazioni IUPAC. Il valore calcolato e' 3.96 x 10-4.
Seconda possibilita' [second case, bad]In questo caso esistono altri ioni in soluzione, a concentrazione per noi incognita che pero' sommano il loro valore a quello dello ione Cl- per l'elettrodo. Il valore di 4.05 x 10-4 mol/L. e' solo in parte dovuto allo ione Cl-.
| SAM | ione Cl- aggiunto | valore teorico | mV letti |
| iniziale, sovrastimato | 4.05 x 10-4 | -203.1 | |
| I aggiunta | 4.00 x 10-4 | 8.05 x 10-4 | -216.9 |
| II aggiunta | 8.00 x 10-4 | 16.05 x 10-4 | -236.5 |
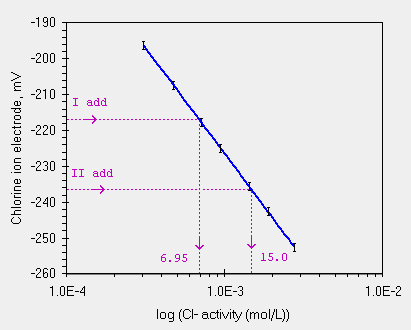 |
| le due Conc. calcolate, diverse ma negli errori sperimentali |
Nel grafico si nota una risposta diversa, con valori troppo lontani dai teorici per poterli ricondurre alla precisione dello strumento. Il calcolo e' molto piu' complesso, si puo' risolvere con un sistema di equazione o con formule specifiche.
La concentrazione ottenuta con il metodo delle aggiunte sembra, circa, 3 x 10-4 mol/L cioe' mancano almeno 1.05 x 10-4 mol/L che o sono prodotti da altri ioni in soluzione, data la selettivita'* dell'elettrodo (I -, Br -, ecc.) oppure da una cattura degli ion Cl - aggiunti (che vanno a formare un complesso con ?).
Abbiamo visto che per tutti questi calcoli e' necessario conoscere con esattezza l'equazione della retta che descrive la risposta dell'elettrodo. Bisogna preparare (come visto in varie slide precedenti) un pool di soluzioni a titolo noto, fare tutte le misure ed i calcoli necessari.
Pero' tutto questo non e' proprio necessario, in un lavoro che stiamo pubblicando descriviamo un metodo di calcolo che per mezzo di un numero sufficiente di aggiunte permette di calcolare sia l'equazione della retta sia la concentrazione incognita iniziale.
Risolvendo il sistema di equazioni per il calcolo esiste la possibilita' che non si ottenga un risultato, appunto nel caso della presenza di ioni interferenti.
* Sempre dalla IUPAC citiamo: As the name suggests, ion selective electrodes are selective to one ion but not specific for it. This means that other ions in solution may also be sensed by an ISE although it is not designed to do so. This is called the selectivity of the electrode.
** Bisognerebbe parlare del Metodo di Gran, dell'Apparent Recovery e di altri metodi di calcolo, vedremo a lezione.
| previous slide | next slide |