| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Cenni di statistica di base. Calcoli di regressioni e correlazioni. novembre 2005 |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous slide, 17b | next slide, 19 |
Fino ad ora tutto il lavoro e' stato concentrato sul definire i punti (sull'asse X) misurare la risposta del sensore-strumento-metodo-ecc., tabellare e graficare il risultato, trovare una zona di linearita', ripetere la misura piu' volte, escludere qualche punto anomalo, ottenere al fine un'equazione della retta.
Nella ricerca chimico-fisica la regressione e' normalmente utilizzata per ottenere un valore (misurandolo) sull'asse Y e ricavare dall'equazione di regressione un valore sull'asse X. Valore a cui va poi associato un errore di misura.
repetita iuvantDiamo alcune regole per ottenere valori regrediti validi:
Con la procedura precedente abbiamo ristretto di molto l'intervallo di linearita' intorno al valore incognito. Addirittura con un simile metodo si potrebbe utilizzare la regressione lineare anche su metodi-strumenti-sensori non lineari poiche' in un piccolo intervallo qualsiasi curva si puo' approssimare ad una retta accettando qualche errore sui risultati (se si prende una corda di 2 gradi su un cerchio si puo' anche approssimare ad una retta accettando un piccolo errore).
Riprendiamo il caso dell'elettrodo sensibile allo ione Cloro in soluzione acquosa, abbiamo deciso di considerarlo lineare con concentrazioni fra 2.24*10-4 mol/L e 0.1 mol/L (con l'aiuto dei 20 punti usati per la regressione).
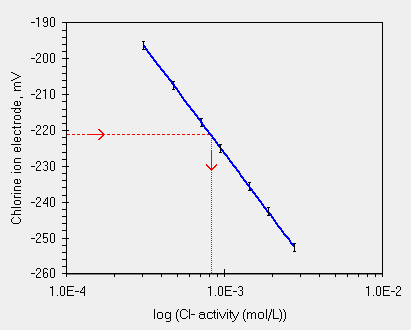
Supponiamo che la nostra soluzione di ioni Cloro abbia una concentrazione intorno a 9.5*10-4 mol/L, simile forse a quella ottenibile dal dilavamento di una parete con efflorescenze.
Prepariamo percio' una serie di 5 (nel nostro caso 7) concentrazioni di ione Cl- cercando di seguire le indicazioni dei punti precedenti, misuriamo la risposta dell'elettrodo, in mV, in queste concentrazioni, ripetiamo le prove (e/o ripetiamo la preparazione delle concentrazioni), otteniamo come curva mediana la seguente:
| Conc. ipotesi | C / 3 | C / 2 | C / 1.5 | C=9.5 x 10-4 | C * 1.5 | C * 2 | C * 3 |
| Conc. mol/L | 3.10 x 10-4 | 4.80 x 10-4 | 7.20 x 10-4 | 9.50 x 10-4 | 1.44 x 10-3 | 1.90 x 10-3 | 2.80 x 10-3 |
| mV misurati | -196.3 | -207.3 | -217.7 | -225.1 | -235.6 | -242.5 | -252.5 |
Da cui si ottiene la retta di regressione qui sotto mostrata.
 |
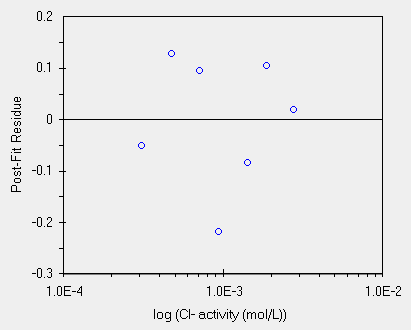 |
| intercetta = -402.8 ± 0.5, pendenza = -58.9 ± 0.17, r = 0.999 | ed ecco il grafico dei residui, una buona distribuzione |
Ora che l'elettrodo e' ben conosciuto nelle sue caratteristiche eseguiamo un piccolo numero di misure, ripetute, della soluzione incognita ottenendo i valori qui sotto riportati. Dopo la misura sarebbe buona norma (specie per un elettrodo!) ripetere la retta di regressione e controllare che i parametri siano nei limiti previsti, per controllare che l'elettrodo non sia stato danneggiato dalla matrice incognita.
| Prova n. | mV misurati | Conc. stimata | Errore stimato |
| 1 | -221.1 | 8.20 x 10-4 | 0.02 |
| 2 | -221.7 | 8.40 x 10-4 | 0.02 |
| 3 | -220.8 | 8.10 x 10-4 | 0.02 |
Ora abbiamo trovato la concentrazione di ione Cl- della soluzione incognita e cosa piu' importante abbiamo verificato il funzionamento di un metodo che ci potra' essere utile in futuro.
La metodologia di indagine e' la stessa, si ipotizza una concentrazione di colorante, si prepara una retta di regressione con almeno 5 punti "intorno" al valore atteso, si misura il valore di assorbanza con lo spettrofotometro (piu' misure) e si ottiene dalla retta di regressione il valore (i valori) della concentrazione.
Pero', essendo diverso lo strumento sono diversi i passaggi e la manualita' necessaria, se ne parlera' a lezione essendo questa una delle esercitazioni previste in laboratorio.
* ove non si sappia nulla di questo valore, disegnare una retta di regressione estesa dal L.O.D. fino alla saturazione del metodo, senza troppa accuratezza, calcolare una equazione approssimata, misurare il valore incognito (asse Y), dall'equazione approssimata ottenere una stima di X.
| previous slide | next slide |