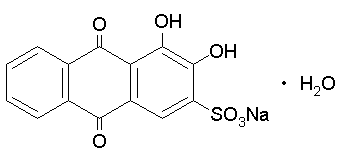
Color Index Name=Alizarin Red S
| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Programmi, orari, esercitazioni |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous | next |
Questa pagina non vuole e non puo' sostituire la lezione ed assolutamente non puo' sostituire il laboratorio ma e' stata scritta per aiutare gli studenti ad inquadrare meglio l'esercitazione teorico/pratica.
i colorantiIl mondo e' a colori, il mondo dell'arte era a colori gia' per gli uomini preistorici, per le prime civilta' cinesi o nate fra i Tigri e l'Eufrate come ci ricorda una bella mostra al Vaticano (I colori del bianco .JPG 413 KBytes)
Quest'anno utilizziamo due coloranti, uno di formula incognita con uno spettro UV-Vis molto ben definito ed un colorante gia' noto agli egizi, anzi ai babilonesi (hanno anche inventato la citta-stato ma la democrazia la portiamo noi!), il Rosso di Robbia, rubia tinctorum, che oggi sappiamo costituito principalmente da Alizarin Red.
obiettivo dell'esercitazioneL'obiettivo e' determinare la concentrazione (in % p/p) di Alizarin Red in una soluzione di vero rosso di robbia. Soluzione preparata sciogliendo radice macinata in acqua distillata. Secondo obiettivo e' determinare la concentrazione di Alizarina in una soluzione incognita, come nel passato il colorante non e' puro ma in miscela per formare una specie di violetto. Abbiamo anche un ipotesi di lavoro (magari per l'esercitazione del prossimo anno), un progetto diagnostico per scoprire la composizione di un colorante rosso incognito.
Utilizzare un colorante sintetico (l'Alizarin Red S) ha vari scopi, fra i tanti la necessita' di usare basse concentrazioni che rendono piu' difficile la pesata, ottenere spettri di assorbimento noti e riproducibili, ottenere soluzioni che possono essere utilizzate per settimane. Pero' al termine della prima esercitazione l'aspetto piu' interessante sono le macchie rosse sparse per il laboratorio, sul bancone, sulla bilancia che mostrano (agli studenti) come sia difficile muoversi in laboratorio, non perdersi polveri e/o soluzioni, ottenere concentrazioni con un qualche grado di accuratezza.
Come detto in precedenza nel Rosso di Robbia (rubia tinctorum, cultivar: madder family) c'e' l'Alizarin Red che produce un colore molto intenso in una soluzione gia' con soli 50 milligrammi in un litro. Quella che segue e' la formula di struttura e alcuni riferimenti utili a chi volesse saperne di piu'.
 |
| CAS number=130-22-3, Color Index=58005, Color Index Name=Alizarin Red S |
Ancor prima di cominciare bisogna decidere con cosa preparare le varie soluzioni per questa e per la prossima esercitazione. Utilizziamo non la normale acqua distillata disponibile per il Dipartimento ma la sottoponiamo ad un'ulteriore processo di purificazione.
 |
| lo strumento misura la conducibilita' dopo il passaggio attraverso le resine |
Come sapete la conducibilita' misura la quantita' di ioni presenti nella soluzione, non misura la presenza di specie non cariche come gas, sostanze organiche, ma per questo noi utilizziamo in ingresso alle resine acqua distillata (cioe' ebollizione e ricondesazione).
Ancor prima di preparare le soluzioni bisognerebbe controllare che tutto il nostro metodo per la preparazione delle concentrazioni a titolo noto produca risultati riproducibili. Per far questo si sceglie uno degli studenti che da ora svolgera' il compito di "pesare", gli altri lavoreranno alla dissoluzione del colorante ma uno solo portera' a volume. Si decide di preparare una concentrazione di 25 mg/L con tre pesate consecutive, utilizzando tre matracci da 500 ml di marche diverse, cercando un accuratezza migliore del 1‰.
 |
| 3 soluzioni per il test della riproducibilita', 3 matracci, 3 pesate |
Questo e' lo spettro del colorante (.jpg, 90KBytes usate Back per tornare qui), ignoto, utilizzato e questi sono i risultati ottenuti per le tre concentrazioni e per i quattro picchi prodotti dalla spettrofotometria di assorbimento nel campo UV-Vis (per i parametri operativi vedi piu' avanti). Guardandolo bene si vedono sei picchi di assorbimento compreso quello di convoluzione nel visibile.
| Conc, mg/L | nm | Abs | a | nm | Abs | a | nm | Abs | a | nm | Abs | a |
| 25.34 | 198.0 | 1.649 | 65.07 | 302.8 | 0.857 | 33.82 | 371.2 | 0.491 | 19.38 | 500.6 | 1.211 | 47.79 |
| 25.28 | 199.0 | 1.579 | 62.46 | 302.0 | 0.837 | 33.11 | 371.2 | 0.477 | 18.87 | 501.0 | 1.207 | 47.75 |
| 24.68 | 198.8 | 1.572 | 63.70 | 302.8 | 0.823 | 33.35 | 371.0 | 0.469 | 19.00 | 501.2 | 1.179 | 47.77 |
| average | 198.6 | 63.74 | 302.5 | 33.43 | 371.1 | 19.08 | 500.9 | 47.77 | ||||
| std. dev. % | 0.266 | 1.45 | 0.153 | 0.77 | 0.031 | 0.97 | 0.061 | 0.03 |
In tabella riportiamo, la concentrazione ottenuta per pesata diretta in mg/L, i nanometri del picco di assorbanza (nm), il relativo valore di assorbanza (Abs), l'assorbanza specifica per un grammo litro (a). Particolare attenzione va posta allo scarto quadratico medio percentuale che usiamo per analizzare questa parte di esercitazione.
In grassetto il valore ottenuto per la riproducibilita' dei nm: lo strumento e' in attensa di una manutenzione straordinaria da 2500 euro, nonostante questo da buoni risultati con qualche problema intorno al limite dei 190 nm. I valori in rosso che ci interessano ci dicono che gli studenti sono riusciti a preparare e misurare con un errore minore del 1%, con un magnifico risultato sul picco del colorante.
Questo e' il peggior risultato ottenibile, era la prima volta che preparavano questa soluzione e che gli veniva richiesto una accuratezza minore dell'uno per mille, che svolgevano una simile procedura (ricordate le tante slide precedenti, conoscere attentamente progetto, metodo, strumento e fare cento prove prima di fare la misura sull'unico campione disponibile). Nella stessa prova il giorno dopo sono stati ottenuti i valori del yy.y% zz.z% ww.w% xx.x% per lo scarto quadratico medio percentuale.
Ora possiamo preparare la serie di soluzioni a titolo noto. Per descrivere meglio la zona di linearita' utilizziamo non i soliti rapporti (1, 2, 5, 10, 20 ....) ma una serie piu' fitta, cioe' 1, 2, 4, 5, 8, 10, 20, 40, ..... . Anche in questa ogni concentrazione ha il suo doppio, il suo x5, il suo x10, ecc. . Poiche' l'equazione dovrebbe essere lineare questa sequenza e' la piu' indicata.
Fino a dove possibile le soluzioni sono preparate per pesata diretta, e per tutte le altre sono prodotte per singola diluizione dalle precedenti, utilizzando per i prelievi o una pipetta a fiato oppure pipetta automatica. Speriamo che al termine gli studenti abbiamo acquisito un poco di manualita' con bilancia analitica, con la vetreria, con la misura dei volumi, con uno strumento analitico molto diffuso.
L'esercitazione si basa sulla misura della concentrazione incognita di un colorante utilizzato da millenni per la tintura di stoffe e qualche volta anche come pigmento.
 |
| da destra, la radice secca sminuzzata, la farina prodotta dalla radice secca, l'estratto secco, il colorante da laboratorio |
Non e' facile trovare oggi dei coloranti e dei pigmenti prodotti artigianalmente, per la fornitura del rosso di robbia che vedete nella foto qui sopra dobbiamo ringraziare il Museo dei Colori Naturali di Lamoli presso L'Oasi San Benedetto si trova a Lamoli frazione del Comune di Borgo Pace sulla statale 73 bis (Bocca Trabaria). Questa citazione e' il minimo che posso fare per ringraziarli.
Questa parte forse andrebbe messa prima ma tutta la vetreria utilizzata e' stata sottoposta ad un accurato lavaggio tipico di un buon laboratorio (senza lavatrice). Per la pulizia e' stato utilizzato il solito metodo del "misto solfo-cromico" come mostrato dalle foto seguenti.
 |
| il misto cromico, pulito a sinistra ed esausto a destra |
Nella foto, a sinistra il Misto Solfo-Cromico fresco e che ha bagnato bene tutte le pareti del matraccio. Pero' potete notare come all'interno si vede una zona non coperta che necessita' di ulteriore lavaggio. A destra invece il tipico colore del Misto esausto.
Dopo aver versato con attenzione il Misto dal matraccio al suo contenitore si lava la vetreria con una piccola quantita' di acqua dolce e si scarica questa soluzione negli acidi diluiti di scarto. Si fanno ora due lavaggi con una gran quantita' d'acqua dolce. Poi si lava due volte con acqua distillata e si controlla il pH ottenuto.
 |
 |
| 1) a sinistra l'acqua di lavaggio, NON va | 2) a destra l'ultimo lavaggio, e' acido |
Si versa in un becker l'acqua distillata usata per il lavaggio e nell'altro l'acqua in uscita dal matraccio. Utilizziamo una cartina di pH per controllare che non ci siano differenze. Nella foto 1) a sinistra l'acqua distillata ed a destra l'acqua di lavaggio sono ancora presenti tracce dell'acido solforico (vedi Miscela Solfo-Cromica) usato per la pulizia, nella foto 2) una vista ravvicinata delle cartine con 4 indicatori piu' accurate di quelle a rotolo, quella di destra indica un pH di circa 4. In questi casi si fanno sempre altri due lavaggi ulteriori con acqua distillata.
Per utilizzare il metodo dei minimi quadrati (O.L.S.) abbiamo deciso di preparare concentrazioni con errore minore di 1‰ e per trovare la zona di linearita' prepariamo una serie di soluzioni, alcune di certo inferiori al L.O.D. del metodo altre di certo superiori alla saturazione e tante in mezzo.
L'esperienza ci suggerisce di preparare le seguenti: 200 mg/L, 100 mg/L, 80 mg/L, 50 mg/L, 40 mg/L, 20 mg/L, 10 mg/L, 8 mg/L, 5 mg/L, 4 mg/L, 2 mg/L, 1 mg/L, 0.8 mg/L, 0.5 mg/L, 0.4 mg/L, 0.2 mg/L, 0.1 mg/L, 0.08 mg/L, 0.05 mg/L, 0.04 mg/L.
 |
| la serie di soluzioni di colorante preparate di fresco |
Quest'anno abbiamo a disposizione anche un matraccio da 10.000 mL (cioe' 10 Litri) con cui possiamo preparare una soluzione da 1 mg/L mantenendo l'errore finale sotto 1‰. Le altre soluzioni devono essere preparate per singola diluizione con il miglior strumento disponibile per il prelievo di un volume. Per minimizzare la possibilita' di errori bisogna randomizzare la scelta della soluzione di partenza. Quello davanti e' il matraccio con la radice di robbia.
Forse qui e' il caso di ricordare che fa parte dell'insegnamento anche tutta la parte legata alla regressione e correlazione (che potete trovare in queste slide) in cui si presentano anche la bilancia analitica (Gibertini E50S), lo spettrofotometro, il metodo dei minimi quadrati, la preparazione di soluzioni a titolo noto.
 |
| bilancia analitica, risoluzione 0.00001 grammi (10 µg) |
Ottenute le soluzioni bisogna misurare l'assorbanza con uno spettrofotometro UV/Vis di qualita'. Abbiamo gia' studiato la riproducibilita' a breve termine nella preparazione delle concentrazioni note eseguendo due set di misure, una il giovedi' ed una il venerdi' (ma le soluzioni vanno conservate al buio essendo l'Alizarina fotolabile quando in soluzione).
 |
| tutti i parametri usati per l'esercitazione |
Dopo aver studiato i menu per il settaggio di tutti i parametri dello spettrofotometro si esegue una prima prova leggendo tutto lo spettro (nel nostro caso da 190nm a 900nm) per una concentrazione intermedia (nel nostro caso 20 mg/L) e da questa si ricavano i picchi, nm, su cui svolgere le misure dell'assorbanza.
Lo spettro e' stampato ma anche registrato su di un file (ricordatevi sempre di scrivere tutti i parametri ed i commenti che finiranno nel file PRIMA di dare start, serviranno fra sei mesi per capire di cosa si tratta). Quello qui sotto riportato e' utile per fare il setting dei parametri che useremo per tutti le altre misure.
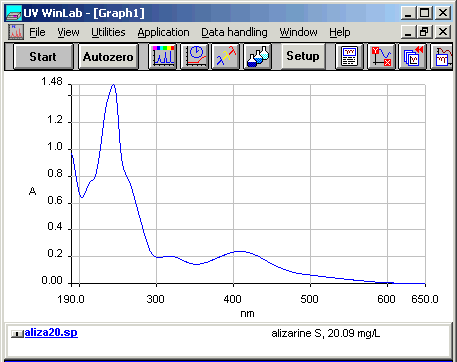 |
| lo spettro dell'Alizarin Red S, colorante del rosso di robbia (with λ shift) |
Solo per rendere un poco piu' difficile le misure cominciamo con la concentrazione da 200 mg/L e via via misuriamo le altre scendendo. Bisogna porre grande cura nel lavare la cuvetta da 10 mm utilizzata e bisogna ripetere la "back calibration" cioe' la linea di base ogni volta che si cambia la scala dell'assorbanza. Con questi dati bisogna costruire una retta di calibrazione, per questo colorante, per questa matrice, per questo spettrofotometro, con queste cuvette e con questa acqua di dissoluzione.
| conc. mg/L | low λ peak-Abs | midl λ peak-Abs | midh λ peak-Abs | high λ peak-Abs |
| 199.72 | 317.6-1.590 | 408.8-2.264 | ||
| 103.30 | 317.0-0.881 | 408.0-1.231 | ||
| 81.44 | 316.2-0.753 | 408.2-0.988 | ||
| look! 50.04 | 243.7-3.302 | 317.4-0.468 | 408.8-0.589 | |
| 41.30 | 243.8-2.928 | 316.6-0.398 | 407.8-0.502 | |
| 20.09 | 243.9-1.480 | 317.2-0.206 | 407.4-0.241 | |
| 10.22 | 244.8-0.723 | 318.4-0.107 | 406.0-0.113 | |
| 8.03 | 244.5-0.590 | 318.6-0.091 | 407.8-0.091 | |
| 5.03 | 244.0-0.373 | 317.2-0.058 | 407.6-0.058 | |
| 4.14 | 244.6-0.308 | 316.6-0.056 | 408.4-0.044 | |
| 2.06 | 243.4-0.167 | 317.26-0.036 | 424.4-0.021 | |
| 1.08 | 193.4-0.050 | 243.6-0.085 | 317.4-0.016 | 411.0-0.012 |
| 0.81 | 190.8-0.031 | 244.4-0.059 | 316.2-0.010 | 410.4-0.009 |
| 0.5 | 243.3-0.035 | 317.3-0.005 | 409.9-0.006 | |
| look! 0.413 | 244.2-0.027 | 316.4-0.003 | 418.2-0.004 | |
| 0.20 | 243.6-0.013 | 320.5-0.002 | 412.4-0.002 | |
| 0.10 | 245.8-0.005 | |||
| 0.08 | noise | noise | noise | noise |
Guardate per favore il valore di 0.413 mg/L, e' davvero difficile individuare i picchi, con qualche tecnica si riesce a scendere ancora ma a 0.08 mg/L c'e' solo rumore.
Ora visto che la nostra e' una analisi quantitativa in spettrofotometria la prima cosa da chiederci e': la posizione del picco cambia con la concentrazione?
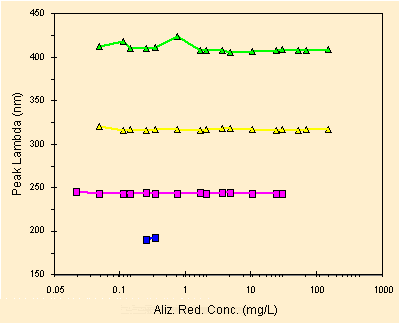 |
| posizione dei picchi in funzione della concentrazione |
Dato questo grafico possiamo continuare, non si notano variazioni significative della posizione, in nanometri, dei picchi percio' non ci dovrebbero essere effetti dovuti alla concentrazione (come invece potremmo vedere per un acido debole, per un indicatore di pH come la fenolftaleina, e per tanti altri esempi).
 |
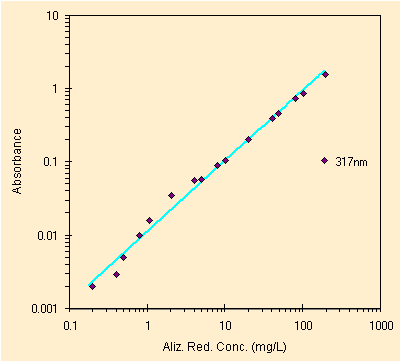
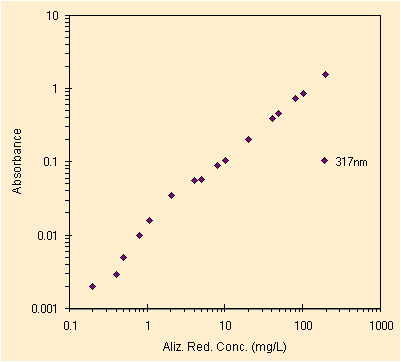 |
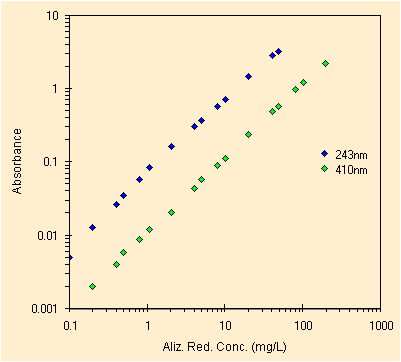
| i due principali picchi del colorante, 16 delle 20 soluzioni | il piccolo e difficile picco a ~317 nm, misurato a mano |
Questa e' la seconda prova, la prima era leggermente meno accurata. La riproducibilita' del metodo e' stata misurata con l'altro colorante rosso ed il risultato era quanto atteso, ora anche questi grafici mostrano una buona linearita'. A quanto pare il laboratorio serve!
Molto ad occhio (sbagliato!) non riusciamo a definire il L.O.D. per i due picchi principali ed invece il picco a 317 sembra mostrare un L.O.D. fra 0.2 et 0.4 mg/L. Ecco gia' un primo insegnamento: il L.O.D. dipende dal picco che decidiamo di utilizzare. Anche al sensibilita' e di conseguenza l'errore sull'incognita' dipendera' dal picco scelto.
Dopo l'esercitazione gli studenti hanno consegnato un file con tutte le letture, questo qui, in cui hanno cercato di evidenziare i due aspetti dell'esercitazione, sia la preparazione delle soluzioni sia le misure spettrofotometriche. Che il file abbia bisogno di una "ritoccata" e' indubbio !!
Partendo dal file fatto dagli studenti ho prodotto una versione con tutti calcoli e con i grafici qui riprodotti, con dentro sia il calcolo della concentrazione incognita del colorante Alizarin Red S nonche' quanto di questo e' contenuto nella radice di Rubia Tinctorum. Solito formato .123 ver. 9.8 da circa 135 KBytes.
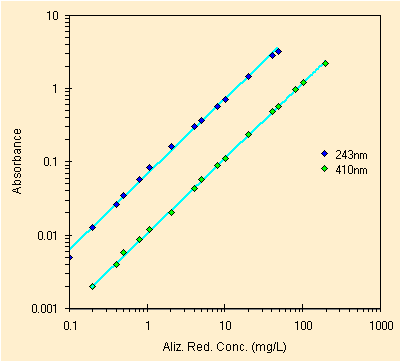 |
 |
| errata regressione usando i due picchi principali | errata regressione usando il quasi picco a ~317 nm |
In ognuno dei tre grafici dovremo rimuovere alcuni picchi. Quello piu' difficile e' disegnato dai ~317 nm, non sembra molto lineare ma e' stato rilevato ogni volta a mano visto che il software spesso non lo considerava nemmeno un picco.
studiamo il picco dell'UVPer la retta dei ~243 nm si nota gia' una saturazione dello strumento a 50 mg/L e questo valore andra' escluso visto che va oltre la linearita' dello strumento (un buon esempio questo). Il picco a ~410 sembra invece che non abbia bisogno di cancellazioni di punti. Puo' essere di aiuto la lettura di tutte le slide sulla regressione.
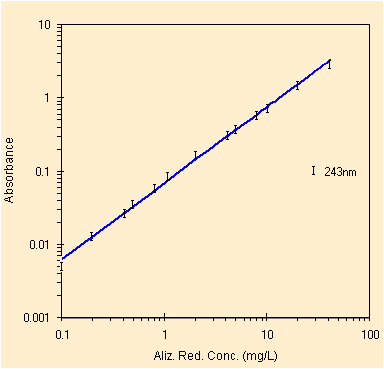 |
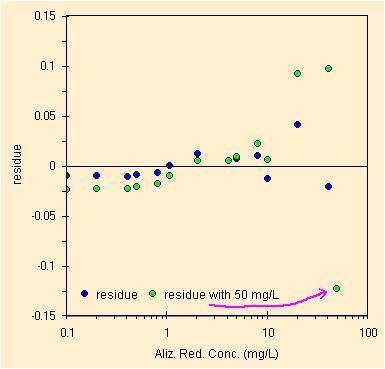 |
| regressione per il picco a ~243 nm, solo 13 conc. | studio dei residui, blu=senza i 50 mg, verde=con |
Solo eliminando il punto in saturazione, con assorbanza ~3.3, si ottiene un netto miglioramento del grafico dei residui. Si passa dai punti in verde a quelli in blu. Ridotto il numero di punti otteniamo i parametri della retta di regressione con il metodo OLS, qui sotto.
| Constant | 0.0078 | Std Err of Constant | 0.0055 | X Coefficient (slope) | 0.0712 | Std Err of X Coef. | 0.0004 |
| R Squared | 0.9996 | Number of observations | 13 | Std Err of Y Estimate (mediane) | 0.0167 | Std Err of X Estimate (mediane) | 0.2341 |
Studiando invece il picco a circa 425 nm, nel visibile, per la II prova bisogna rimuovere solo un outlier davvero da manuale ed il valore a piu' bassa concentrazione.
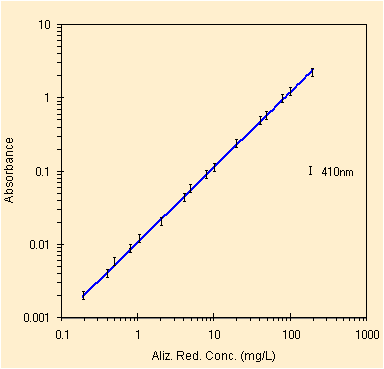 |
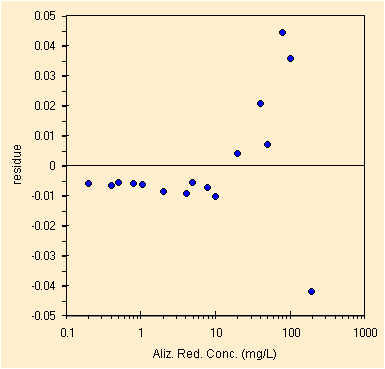 |
| regressione per il picco a ~410 nm, con 16 conc. | studio dei residui, la scala logaritmica pero' .... |
Dobbiamo confrontare il grafico dei residui con quello precedente, solo i punti in blu. La scala logaritmica falsa la rappresentazione. Mantenendo tutti i punti otteniamo i parametri della retta di regressione con il metodo OLS, qui sotto.
| Constant | 0.0056 | Std Err of Constant | 0.0061 | X Coefficient (slope) | 0.0115 | Std Err of X Coef. | 0.0001 |
| R Squared | 0.9990 | Number of observations | 16 | Std Err of Y Estimate (mediane) | 0.0207 | Std Err of X Estimate (mediane) | 1.7982 |
Comunque il lavoro fatto dagli studenti sembra buono, 0.9996 et 0.999 di R2 seppur dopo la cancellazione di alcuni punti e' un buon risultato.
Gli studenti hanno avuto a disposizione una quantita' di soluzione per solo due prove, sono state usate sempre le cuvette da 10 mm di cammino ottico, che contengono circa 3.5 mL di soluzione.
| Robbia prova n. |
picco nm | assorbanza | concen. calc. | media | errore stimato |
| 1 | 236.0 | 0.590 | 8.18 | 8.20 | 0.23 |
| 417.6 | 0.088 | 7.15 | |||
| 2 | 235.4 | 0.593 | 8.22 | ||
| 417.6 | 0.089 | 7.24 | 7.20 | 1.79 |
Ricordiamo che abbiamo pesato 204.8 mg/L di radice di robbia secca. Con un click qui sopra possiamo vedere il grafico ottenuto allo spettrofotometro. Nella tabella qui sopra le concentrazioni stimate, per le due prove fatte, di Alizarin presente in soluzione.
Noterete un problema: il risultato differisce di 1 mg/L che su di un valore di 8 e' molto, ma guardando gli errori associati alla X regredita si possono fare alcune considerazioni. La prima e' che i valori sono compatibili, nel grafico qui sotto evidenziamo i valori minimo e massimo possibili per i due picchi e come si nota i valori a 417 nm contengono quelli a 235. La seconda e' che il picco UV dell'Alizarina e' a 243 nm e questo invece a 235 per cui il valore di 8.20 mg/L non e' affidabile.
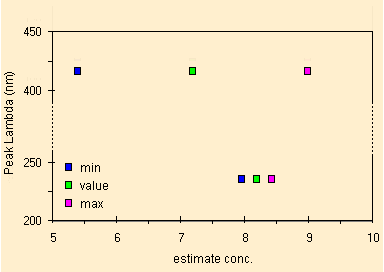 |
| i valori in verde e la stima della dispersione del risultato |
Dato che la soluzione di partenza era di 204.8 mg/L e che il probabile valore di Alizarina e' di 7.2 mg/L possiamo calcolare che il colorante sia presente al 3.5% (salvo qualche perdita per centrifugazione, estrazione, ecc.).
concentrazione incognitaAnche questa volta gli studenti avevano a disposizione soluzione solo per due prove e le stesse cuvette da 10 mm di cammino ottico.
| incognita prova n. |
picco nm | assorbanza | concen. calc. | media | errore stimato |
| 1 | 244.2 | 1.482 | 20.70 | 20.74 | 0.23 |
| 316.2 | 0.233 | 25.69 | 25.75 | 3.85 | |
| 406.7 | 0.238 | 20.18 | |||
| 2 | 244.0 | 1.487 | 20.77 | ||
| 316.2 | 0.234 | 25.82 | |||
| 405.8 | 0.240 | 20.35 | 20.26 | 1.79 |
I due picchi utilizzati in precedenza danno un valore stimato molto simile, quando invece il piccolo picco (ricordiamo misurato a mano) fornisce un valore diverso. Il grafico qui sotto conferma le differenze dei risultati.
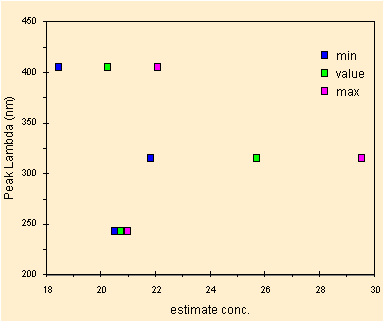 |
| i valori in verde e la stima della dispersione del risultato |
Non consideriamo i 316 nm. Le misure partendo da UV e Visibile sono consistenti, sono plausibili graficando gli errori sulla stima di X, effettamente si vede che frequentare il laboratorio e' utile.
A proposito la concentrazione incognita era, ed il suo spettro era il seguente, cioe' una soluzione di due coloranti, si apprezza appena un blu nel suo picco UV cerchiato in viola.
Al termine bisogna evidenziare un errore di tutto il progetto, che di certo un lettore attento avra' gia' individuato, il colorante industriale qui utilizzato e' solfonato, e stiamo usando il sale sodico, questo perche' e' molto piu' solubile della versione senza il gruppo SO3Na presenta nella radice. Questo porta a diversita' negli spettri e ad errori nel calcolo della concentrazione, si ma stimabili in qualche %
| Universita' Degli Studi di Roma La Sapienza |
Dr. G. Visco appointed professor for chemometrics & .... |
Dipartimento di Chimica |
| previous | next |