Color Index Name=Alizarin Red S
| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Programmi, orari, esercitazioni |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous | next |
Questa pagina non vuole e non puo' sostituire la lezione ed assolutamente NON puo' sostituire il laboratorio ma e' stata scritta per aiutare gli studenti ad inquadrare meglio l'esercitazione teorico/pratica.
il coloranteIl mondo e' a colori, il mondo dell'arte era a colori gia' per gli uomini preistorici, per le prime civilta' cinesi o nate fra i Tigri e l'Eufrate come ci ricorda una bella mostra al Vaticano (I colori del bianco .JPG 413 KBytes)
Quest'anno stiamo utilizzando un colorante gia' noto agli egizi, anzi ai babilonesi (pero' noi gli portiamo la democrazia!), il Rosso di Robbia, rubia tinctorum, che oggi sappiamo costituito principalmente da Alizarin Red S.
Utilizzare un colorante ha vari scopi, fra i tanti la necessita' di usare basse concentrazioni che rendono piu' difficile la pesata, ottenere spettri di assorbimento noti e riproducibili, ottenere soluzioni che possono essere utilizzate per settimane. Pero' al termine della prima esercitazione l'aspetto piu' interessante sono le macchie rosse sparse per il laboratorio, sul bancone, sulla bilancia che mostrano (agli studenti) come sia difficile muoversi in laboratorio, non perdersi polveri e/o soluzioni, ottenere concentrazioni con un qualche grado di accuratezza.
Come detto in precedenza nel Rosso di Robbia (rubia tinctorum, cultivar: madder family) c'e' l'Alizarin Red S che produce un colore molto intenso in una soluzione gia' con soli 50 milligrammi in un litro. Quella che segue e' la formula di struttura e alcuni riferimenti utili a chi volesse saperne di piu'.
 |
| CAS number=130-22-3, Color Index=58005, Color Index Name=Alizarin Red S |
Per prima cosa bisogna preparare una serie di soluzioni a titolo noto. Per descrivere meglio la zona di linearita' utilizziamo non i soliti rapporti (1, 2, 5, 10, 20 ....) ma una serie piu' fitta, cioe' 1, 2, 4, 5, 8, 10, 20, 40, ..... . Anche in questa ogni concentrazione ha il suo doppio, il suo x5, il suo x10, ecc. . Poiche' l'equazione dovrebbe essere lineare questa sequenza e' la piu' indicata.
Fino a dove possibile le soluzioni sono preparate per pesata diretta, e per tutte le altre sono prodotte per singola diluizione dalle precedenti, utilizzando per il volumi una pipetta automatica (tarandola prima della misura). Speriamo che al termine gli studenti abbiamo acquisito un poco di manualita' con bilancia analitica, con la vetreria, con la misura dei volumi, con uno strumento analitico molto diffuso.
Vengono preparate le seguenti: 200 mg/L, 100 mg/L, 80 mg/L, 50 mg/L, 40 mg/L, 20 mg/L, 10 mg/L, 8 mg/L, 5 mg/L, 4 mg/L, 2 mg/L, 1 mg/L, 0.8 mg/L, 0.5 mg/L, 0.4 mg/L, 0.2 mg/L, 0.1 mg/L, 0.08 mg/L, 0.05 mg/L, 0.04 mg/L.
 |
| la serie di soluzioni di pigmento preparate di fresco |
Avendo deciso di ottenere un errore, sulla concentrazione finale, minore dello 0.1% ci dobbiamo fermare alla concentrazione di 2 mg/L se utilizziamo un matraccio da 5 litri. Le altre soluzioni devono essere preparate per singola diluizione con il miglior strumento disponibile per il prelievo di un volume. Per minimizzare la possibilita' di errori bisogna randomizzare la scelta della soluzione di partenza.
Forse qui e' il caso di ricordare che fa parte dell'insegnamento anche tutta la parte legata alla regressione e correlazione (che potete trovare in queste slide) in cui si presentano anche la bilancia analitica (Gibertini E50S), lo spettrofotometro, il metodo dei minimi quadrati, la preparazione di soluzioni a titolo noto.
 |
| bilancia analitica, risoluzione 0.00001 grammi (10 µg) |
Ottenute le soluzioni bisogna misurare l'assorbanza con uno spettrofotometro UV/Vis di qualita'. Per studiare la riproducibilita' a lungo termine delle misure eseguiamo due set di misure, una il lunedi' ed una il venerdi'
 |
| i menu a video dello spettrofotometro double beam |
Dopo aver studiato i menu per il settaggio di tutti i parametri dello spettrofotometro si esegue una prima prova leggendo tutto lo spettro (nel nostro caso da 190nm a 900nm) per una concentrazione intermedia (nel nostro caso 8 mg/L) e da questa si ricava la scala dell'assorbanza da utilizzare ed un primo disegno dello spettro.
Lo spettro stampato sul registratore e' poi passato allo scanner, digitalizzato ed acquisito con il foglio elettronico. Quello qui sotto riportato e' utile per fare il setting dei parametri che useremo per tutti gli altri.
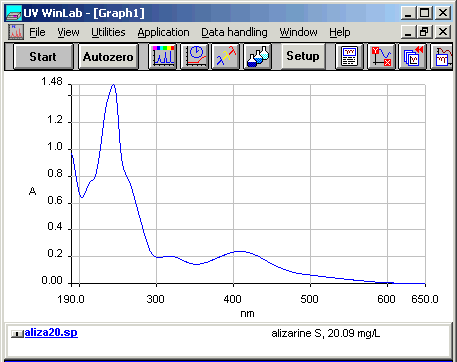 |
| lo spettro dell'Alizarin Red, colorante del rosso di robbia |
Sono disponibili tre spettri passati allo scanner per le seguenti concentrazioni di Alizarin, bassa 0.80 mg/L, media 8.03 mg/L, alta 80.36 mg/L. Ricordate di usare il pulsante Back per tornare qui dopo aver letto questi .JPG da circa xxxx KBytes.
Il primo set di misura inizia con la concentrazione piu' bassa passando via via a quella con concentrazione maggiore, il secondo al contrario. Bisogna porre grande cura nel lavare la cuvetta da 10 mm utilizzata e bisogna ripetere la "back calibration" cioe' la linea di base ogni volta che si cambia la scala dell'assorbanza. Con questi dati bisogna costruire una retta di calibrazione, per questo colorante, per questa matrice, per questo spettrofotometro, con queste cuvette e con questa acqua di dissoluzione.
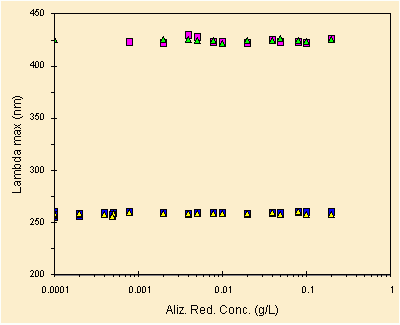 |
| posizione dei picchi in funzione della concentrazione |
Dato questo grafico possiamo continuare, non si notano variazioni significative della posizione, in nanometri, dei picchi percio' non ci dovrebbero essere effetti dovuti alla concentrazione (come invece potremmo vedere per un acido debole per esempio).
 |
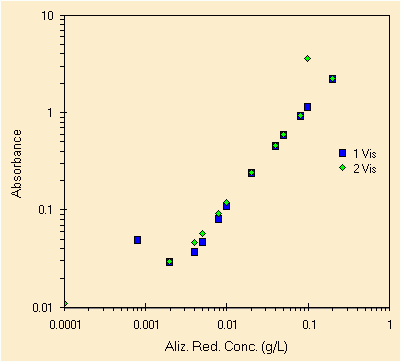 |
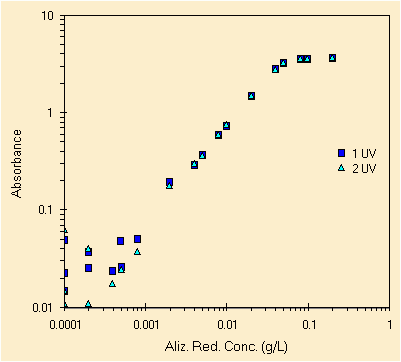
| due prove con le 20 soluzioni, picco a ~260 nm | le stesse soluzioni ma leggendo il picco a ~425 nm |
Fra le due prove c'e' una settimana di differenza e si vede. La prima prova in blu mostra piu' difetti, la seconda, sia quella in acquamarina che in verde sono migliori. Purtroppo le soluzioni sono state preparate una volta sola, di certo che se ci fosse stata una seconda prova per la preparazione delle 20 soluzioni i risultati sarebbero molto migliori specie per le basse concentrazioni, da sempre le piu' difficili. A quanto pare il laboratorio serve!
Molto ad occhio (sbagliato!) possiamo definire il L.O.D. come 2 mg/L per il picco a circa 425 nm ed invece per il picco a circa 260 nm il L.O.D. e' vicino ai 0.2 mg/L. Utilizzando pero' la seconda prova.
Dopo l'esercitazione gli studenti hanno consegnato un file con tutte le letture, questo qui, in cui hanno cercato di evidenziare i due aspetti dell'esercitazione, sia la preparazione delle soluzioni sia le misure spettrofotometriche. Che il file abbia bisogno di una "ritoccata" e' indubbio !
Partendo dal file fatto dagli studenti ho prodotto una versione con tutti calcoli e con i grafici qui riprodotti per il calcolo della concentrazione incognita del colorante Alizarin Red S. Solito formato .123 ver. 9.8 da circa 110 KBytes.
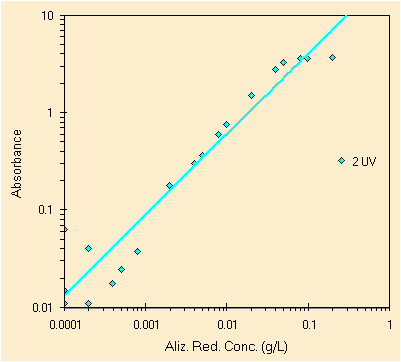 |
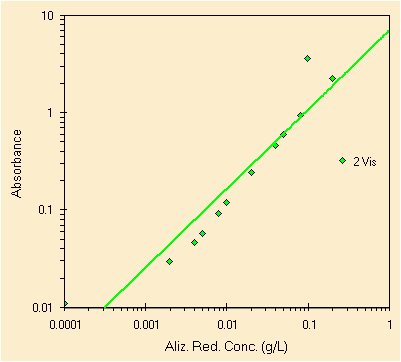 |
| errata regressione usando il picco a ~260 nm | errata regressione usando invece il picco a ~425 nm |
Iniziamo dal picco a circa 260 nm, nell'UV, dobbiamo rimuovere alcuni punti, i tre a piu' alta concentrazione che come si puo' notare sono oltre la linearita' dello strumento (un buon esempio questo). Bisogna inoltre rimuovere selettivamente alcuni valori a bassa concentrazione che provengono da soluzioni sbagliate o da letture sbagliate. Puo' essere di aiuto la lettura di tutte le slide sulla regressione.
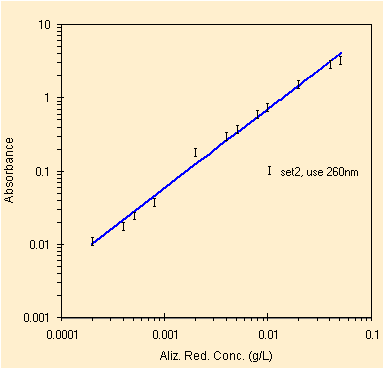 |
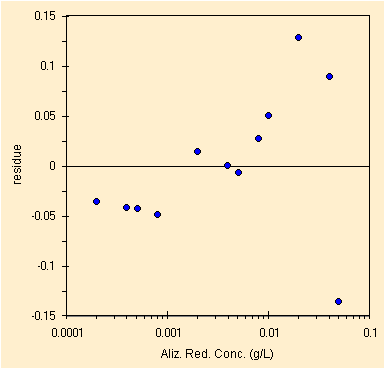 |
| regressione per il picco a ~260 nm, solo 12 conc. | studio dei residui, ancora qualche problema in alto |
Ridotto il numero di punti otteniamo i parametri della retta di regressione con il metodo OLS, qui sotto.
| Constant | 0.033 | Std Err of Constant | 0.026 | X Coefficient (slope) | 67.604 | Std Err of X Coef. | 1.318 |
| R Squared | 0.996 | Number of observations | 12 | Std Err of Y Estimate (mediane) | 0.073 | Std Err of X Estimate (mediane) | 0.001 |
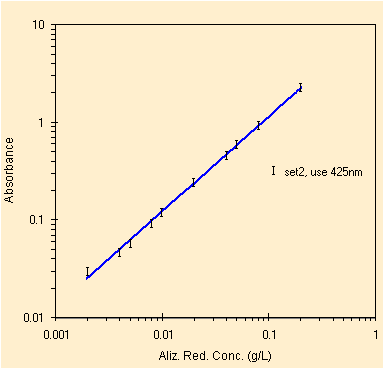
Studiando invece il picco a circa 425 nm, nel visibile, per la II prova bisogna rimuovere solo un outlier davvero da manuale ed il valore a piu' bassa concentrazione.
 |
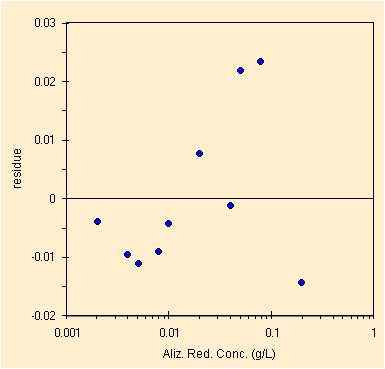 |
| regressione per il picco a ~425 nm, solo 10 conc. | studio dei residui, la scala logaritmica pero' .... |
Il grafico dei residui non mostra la distanza del punto a concentrazione 0.002 gr/L dalla retta di regressione vista la doppia scala logaritmica. Comunque anche lasciando questo punto la regressione e' buona con i parametri qui sotto.
| Constant | 0.011 | Std Err of Constant | 0.006 | X Coefficient (slope) | 11.316 | Std Err of X Coef. | 0.077 |
| R Squared | 0.999 | Number of observations | 10 | Std Err of Y Estimate (mediane) | 0.014 | Std Err of X Estimate (mediane) | 0.001 |
Comunque il lavoro fatto dagli studenti sembra buono, 0.996 et 0.999 di R2 seppur dopo la cancellazione di alcuni punti e' un buon risultato.
Gli studenti hanno avuto a disposizione una quantita' di soluzione per solo due prove, sono state usate sempre le cuvette da 10 mm di cammino ottico, che contengono circa 3.5 mL di soluzione.
Con le due rette di regressione si ottengono i valori qui sotto:
| prova n. | picco nm | assorbanza | concen. calc. | media |
| 1 | 227.4 | 0.643 | ||
| 259.0 | 0.871 | 0.0124 | 0.0124 | |
| 422.6 | 0.135 | 0.0109 | ||
| 2 | 227.0 | 0.640 | ||
| 259.2 | 0.870 | 0.0124 | ||
| 423.0 | 0.133 | 0.0108 | 0.0109 |
Ottima riproducibilita' delle misure, si vede che frequentare il laboratorio e' utile. Ora bisognerebbe scegliere se usare il picco del colore o quello dell'UV visto che l'assorbanza misurata cade nella zona di linearita' di entrambi.
A proposito la concentrazione incognita era, ed il suo spettro era il seguente, cioe' una soluzione di due coloranti, si apprezza appena un blu.
| Universita' Degli Studi di Roma La Sapienza |
Dr. G. Visco appointed professor for chemometrics & .... |
Dipartimento di Chimica |
| previous | next |