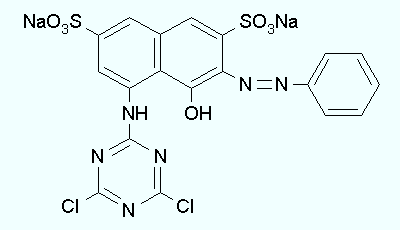
Color Index Name=Reactive Red 2
| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Programmi, orari, link alle lezioni |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous | next |
Un cenno all'esercitazione n. 1 dell'Insegnamento di Laboratorio di Chimica del Restauro e della Conservazione nel Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione.
il coloranteUtilizzare un colorante industriale ha vari scopi, fra i tanti la necessita' di usare basse concentrazioni che rendono piu' difficile la pesata, ottenere spettri di assorbimento noti e riproducibili, ottenere soluzioni che possono essere utilizzate per settimane. Pero' al termine della prima esercitazione l'aspetto piu' interessante sono le macchie rosse sparse per il laboratorio, sul bancone, sulla bilancia che mostrano (agli studenti) come sia difficile muoversi in laboratorio, non perdersi polveri e/o soluzioni, ottenere concentrazioni con un qualche grado di accuratezza.
Utilizziamo percio' il Procion Red MX-5B che produce un colore molto intenso in una soluzione gia' con soli 50 milligrammi in un litro. Quella che segue e' la formula di struttura e alcuni riferimenti utili a chi volesse saperne di piu'.
 |
| CAS number=17804-49-8, Color Index=18200, Color Index Name=Reactive Red 2 |
Per prima cosa bisogna preparare una serie di soluzioni a titolo noto. Per descrivere meglio la zona di linearita' utilizziamo non i soliti rapporti (1, 2, 5, 10, 20 ....) ma una serie piu' fitta, cioe' 1, 2, 4, 5, 8, 10, 20, 40, ..... . Anche in questa ogni concentrazione ha il suo doppio, il suo x5, il suo x10, ecc. . Poiche' l'equazione dovrebbe essere lineare questa sequenza e' la piu' indicata.
Fino a dove possibile le soluzioni sono preparate per pesata diretta, e per tutte le altre sono prodotte per singola diluizione dalle precedenti, utilizzando per il volumi una pipetta automatica (tarandola prima della misura). Speriamo che al termine gli studenti abbiamo acquisito un poco di manualita' con bilancia analitica, con la vetreria, con la misura dei volumi, con uno strumento analitico molto diffuso.
Vengono preparate le seguenti: 80 mg/L, 50 mg/L, 40 mg/L, 20 mg/L, 10 mg/L, 8 mg/L, 5 mg/L, 4 mg/L, 2 mg/L, 1 mg/L, 0.8 mg/L, 0.5 mg/L, 0.4 mg/L, 0.2 mg/L, 0.1 mg/L, 0.08 mg/L, 0.05 mg/L.
 |
| la serie di soluzioni di colorante preparate di fresco |
Forse qui e' il caso di ricordare che fa parte dell'insegnamento anche tutta la parte legata alla regressione e correlazione (che potete trovare in queste slide) in cui si presentano anche la bilancia analitica (Gibertini E50S), lo spettrofotometro, il metodo dei minimi quadrati, la preparazione di soluzioni a titolo noto.
 |
| bilancia analitica, risoluzione 0.00001 grammi (0.01 mg) |
Ora di tutte queste soluzioni sara' misurata l'assorbanza con uno spettrofotometro UV/Vis di qualita'. Da tutte queste soluzioni si ricava la retta di calibrazione dello strumento del colorante in soluzione acquosa.
Dopo aver studiato i menu per il settaggio di tutti i parametri dello spettrofotometro si esegue una prima prova leggendo tutto lo spettro (nel nostro caso da 190nm a 900nm) per una concentrazione intermedia (nel nostro caso 5 mg/L) e da questa ricavando la parte dello spettro da studiare. Dopo l'esercitazione si ottiene un file con tutte le letture, come questo, in cui si evidenzia il doppio picco di assorbimento.
 |
| i menu a video dello spettrofotometro double beam |
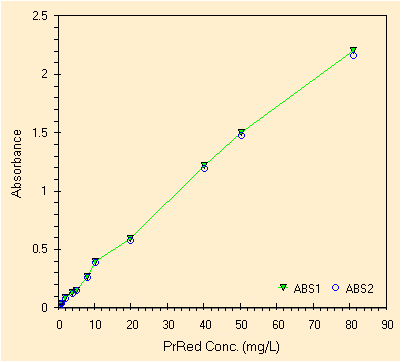
Con i dati precedenti bisogna costruire una retta di calibrazione, per questo colorante, per questa matrice, per questo spettrofotometro, con queste cuvette, come quella in figura. Avendo a disposizione due picchi si possono costruire due curve di calibrazione, si puo' scegliere quella con range piu' esteso, quella con la miglior correlazione, quella con il termine noto piu' vicino a zero. Qui di seguito sono calcolati i parametri per il picco a circa 510 nm.
Si nota subito che non si possono utilizzare tutti e 20 i punti. La zona ad alte concentrazioni e' lineare, con qualche incertezza begli 8 e nei 10 mg/L. Invece la zona a basse concentrazioni e' come sempre piu' problematica. Gli studenti in questo caso si sono accorti di un paio di errori a 0.4 e 0.5 mg/L ed hanno ripetuto le misure ed inoltre hanno curato con attenzione la zona di non linearita'.
 |
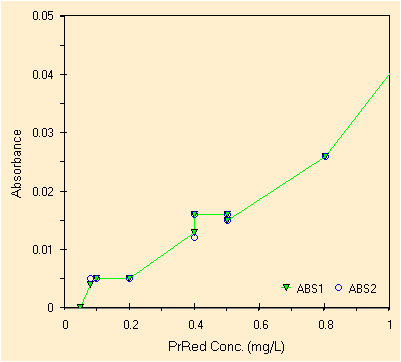 |
| retta di calibrazione rilevata, alte concentrazioni | retta di calibrazione rilevata, basse concentrazioni |
Dopo aver scelto fra i valori ripetuti quello che meglio si allinea alla curva, dopo aver escluso le concentrazioni piu' basse si ottiene una retta di calibrazione con soli 14 punti (con linearita' fra 0.2 ed 80 mg/L) con i seguenti parametri.
| Constant | 0.0284 | Std Err of Constant | 0.0154 | X Coefficient (slope) | 0.0279 | Std Err of X Coef. | 0.0005 |
| R Squared | 0.9955 | Assess of Std Err of R squared | 0.0194 | Std Err % of Y Estimate | 10.0 % | Std Err % of X Estimate | 10.6 % |
| Variance of residuals | 0.0023 | Number of observations | 14 | Linearity range, mg/L | 0.2 - 80 | Baricenter, X value | 16.0 |
Ora, data la retta di calibrazione l'esercitazione prevede la misura di due concentrazioni incognite di colorante, una in acqua distillata, una in una matrice piu' complessa. Attenzione pero' che la non perfetta retta di calibrazione e la mancanza di ripetizioni* della retta portano ad un largo errore in previsione.
Al termine dell'esercitazione possiamo affermare che i risultati prodotti dagli studenti sono all'interno dell'errore del 10% che era atteso, nonostante la difficolta' della seconda prova.
La seconda parte dell'esercitazione prevede lo studio dello spettro di alcuni pigmenti con colori intensi usati spesso nei restauri di affreschi, i seguenti: rosso cadmio laccato, blu oltremare, bianco di zinco, terra di Siena naturale1, terra di Siena naturale2, terra verde, terra ombra bruciata, terra ombra naturale, nero d'avorio, ocra gialla.
 |
| i pigmenti utilizzati per l'esercitazione, |
Qui si presentano vari problemi (che come al solito servono a far conoscere agli studenti qualche strumento ed un poco di manualita'). il primo e' la bassa solubilita' di questi ossidi e terre, poi la necessita' di chiarificare la soluzione prima della misura dell'assorbanza, poi il basso assorbimento di queste soluzioni.
Si cercano due risposte: dati due pigmenti venduti, a distanza di un anno, come identici lo sono davvero; due pigmenti proposti come diversi lo sono davvero visto che ad occhio sembrano uguali.
Per ogni pigmento prepariamo una soluzione di 50 mg/L in acqua distillata aiutando la dissoluzione con un agitatore magnetico.
Di solito questa esercitazione mette in evidenza molti problemi fra cui:
Tutti questi punti sono descritti a lezione, in particolare sono date soluzioni per i punti 3, 4, 6 che possono migliorare anche di molto la misura.
Per rispondere alla due domande, sono uguali o sono diversi, nell'esercitazione possiamo usare un trucco che ci permette di dare direttamente la risposta (dopo aver applicato tutte le correzioni gia' viste).
* per una vera calibrazione i testi di Chemiometria insegnano che le ripetizioni devono partire dalla preparazione di piu' soluzioni a titolo noto, uguale, e devono essere distribuite nel tempo. Cioe' prepariamo piu' volte, nei giorni, una soluzione da 0.8 mg/L e con ognuna in piu' giorni facciamo piu' misure.
| Universita' Degli Studi di Roma La Sapienza |
Dr. G. Visco appointed professor for chemometrics & .... |
Dipartimento di Chimica |
| previous | next |